



J. Mater. Sci. Technol.(Volume 128, Pages 221-227)
https://doi.org/10.1016/j.jmst.2022.04.018

全文速览
近日,四川大学医疗器械监管科学研究院联合国家药品监督管理局医疗器械技术审评中心、河北工业大学生命科学与健康工程学院及美国Rice大学组织工程研究中心等研究团队,在Journal of Materials Science & Technology上,发表题为“Biomaterials and Regulatory Science”的主旨文章。在生物材料和监管科学领域内,于国际首次全面阐述并明晰了生物材料和监管科学是通过它们与生物材料医疗产品及其安全性和有效性评估相紧密关联。
文章首先介绍了生物材料的最新定义,以及与生物材料相关的医疗产品和所谓的医用级和植入级材料的概念。随后简述了监管科学的概念、历史及其对医疗产品安全性和有效性的评估,以及各国监管机构目前正在开展的与生物材料相关的监管科学计划。最后,讨论了监管科学为生物材料所提供的机遇以及开发基于生物材料的监管科学体系所面临的挑战。

背景介绍
医疗产品是保障人民安全和健康的必需品。随着现代科技的爆炸式发展,医疗产品尤其是创新医疗产品的高速发展的给监管部门带来了挑战。为保证医疗产品的安全、有效、质量和性能,实现医疗产品的高效和科学监管,监管科学的发展迫在眉睫。

本文亮点
(1) 首次阐明生物材料与监管科学的关系;
(2) 明晰生物材料、生物材料医疗产品和监管科学等基本概念;
(3) 总结和评述生物材料相关监管科学计划的研究进展;
(4) 为今后生物材料和监管科学领域研究提供可借鉴的思路和建议。

图文解析
(1)生物材料、生物材料医疗产品、监管科学和监管机构之间的关系
本文首次阐明了生物材料、生物材料医疗产品、监管科学和监管机构之间的关系,如图1所示。生物材料、监管科学和监管机构的交汇点为生物材料医疗产品,其为安全性和有效性的主体;生物材料转化成为生物材料医疗产品,生物材料为医疗产品的一部分;监管机构批准的是终端医疗产品;监管科学通过评估医疗产品的安全有效来实现监管机构和医疗产业的使命,满足其需求。

图1. 生物材料、生物材料医疗产品、监管科学和监管机构之间的关联。
(2)生物材料、生物材料医疗产品和监管科学相关基本概念
“生物材料是一种设计成特定形态,通过与生命系统相互作用,能够直接影响治疗或诊断进程的材料”。生物材料不是医疗产品,而是医疗产品的关键组成部分。这里的医疗产品是指受监管机构监管的医疗器械、体外诊断试剂和仪器、药品、生物制品和组合产品。为了成为终产品,生物材料需要根据终产品的应用需求进行专门设计和工程化,消除不可接受的风险,同时通过台架试验,生物相容性,生物安全性,临床前与临床评价,以及上市后监管,获得预期受益(图 2)。
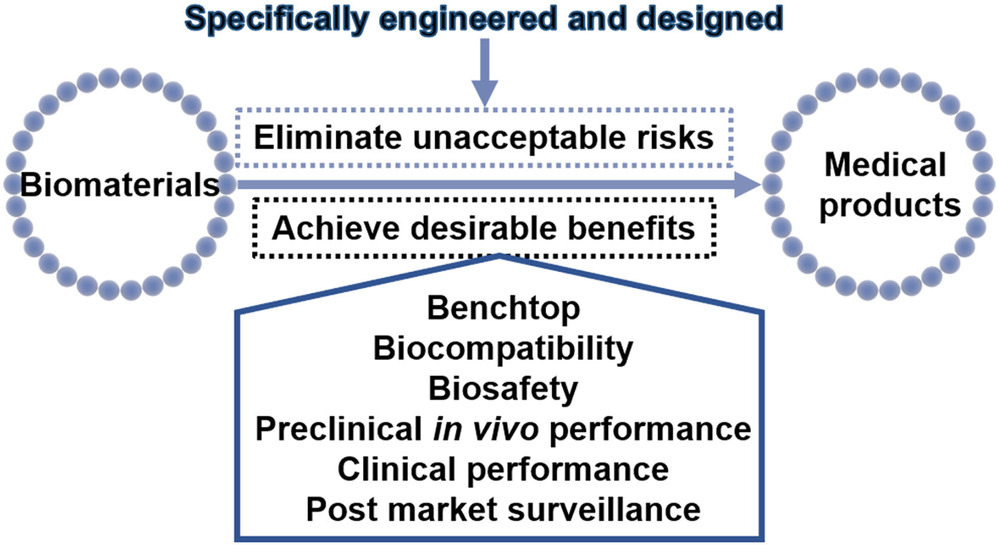
图2. 从生物材料转化为医疗产品:生物材料是医疗产品的关键组成部分。
“医用级材料”一词可追溯到符合美国药典(USP) I 至 VI 类的医药包装材料。“植入级材料”通常指用于植入器械的生物材料。虽然没有“医用级和植入级材料”的法规定义,但监管机构认可用于医疗产品的相关材料标准。
“监管科学是开发新工具,标准和途径以评估受监管产品的安全、有效、质量和性能的科学”。其源于监管机构的使命和需求,包括服务于医疗产品各个方面的科学研究和活动,包括但不限于注册、研究、开发、质量和生产。监管科学及其新工具、标准、途径、技术、知识和方法为生产者和监管决策者提供科学证据,以确保医疗产品的安全有效。监管科学涉及自然科学、医学与健康科学、人文社会科学等诸多研究领域,是一个新兴的前沿交叉学科领域。本文对监管科学的历史沿革进行了归纳如图3所示。
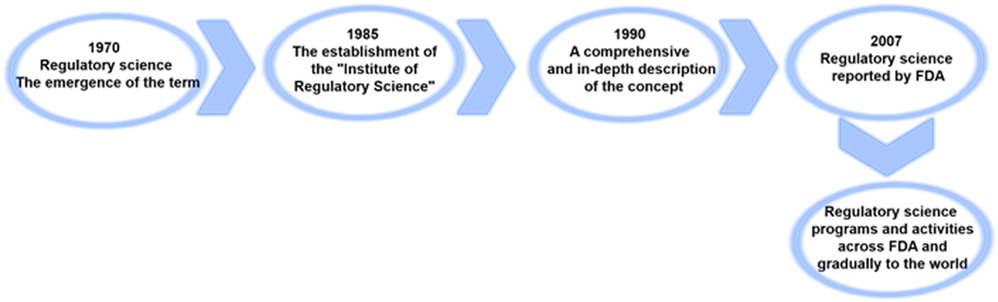
图3. 监管科学发展的历史沿革。
对于医疗器械,“安全”定义为“无不可接受的风险”,而“有效”定义为“在绝大多数目标人群中具有显著临床效果的能力”。安全的定义是基于风险的可接受性,而有效的定义是基于受益的可接受性。但是,风险的可接受性离不开受益,受益的可接受性也离不开风险。安全和有效之间有许多相似之处,并且这两个概念都不是绝对的,因为两者都是通过受益或危害的概率和重要性来评估的。两者也可以通过医疗(临床)需求、目标人群和使用条件的共同要素相互联系。
(3)生物材料相关监管科学研究进展
美国食品药品管理局(FDA)于2019 年发布了两项官方声明,即《关于评估用于医疗器械的材料以解决潜在安全问题的声明》和《关于继续评估用于医疗器械的材料以解决潜在安全问题的声明》。一方面,FDA 加强了上市前评估,以确定医疗器械的组成材料与人体接触时是否存在潜在的不良生物反应以及相关风险是否可接受。另一方面,FDA一直通过对已上市医疗器械的上市后跟踪和评估,加强对潜在高风险产品的上市后监管。
国家药品监督管理局(NMPA)于2019年启动了中国药品监管科学行动计划(即“计划”)。该计划的第一批(2019年4月)和第二批(2021年6月)均包括用于医疗器械的新型生物材料项目,以期解决使用新型生物材料的医疗器械评价和监管面临的问题。中华人民共和国科学技术部国家重点研发计划项目“生物医用材料研发与组织器官修复替代(2016-2020)”以及“诊疗装备和生物医用材料(2021-2025)”均包含医疗器械用新型生物材料的监管审评科学研究项目。由国家药监局医疗器械技术审评中心发起的“生物材料创新合作平台”于2021年4月15日正式成立。该平台拟通过协调学术界、科研院所、产业界、医疗卫生和政府部门的资源,构建开放、协同的生物材料相关医疗器械创新体系,形成服务于医疗器械科学监管、技术创新和转化,以及行业自律的良好互动环境。
(4)将监管科学应用于生物材料
监管科学为生物材料及其医疗产品提供了巨大的机遇。含新工具、新标准、新途径、新技术、新知识和新方法的监管科学可以作为桥梁和催化剂,加速生物材料医疗产品的研究、开发与转化。监管科学所形成的科学证据还可以对生物材料医疗产品进行有效的和高效的技术审评、注册批准和上市后监管。因此,可以将更快、更好地将更具创新性的医疗产品推向市场。
完善界定和分类体系、开发标准和建立医疗器械主文档是将监管科学应用于生物材料的具体体现。本文进一步提出可以建立基于生物材料的监管科学体系,其包括临床应用、关键生物材料和技术以及监管科学产出三个维度(图4)。这三个维度与临床需求和技术进步密切相关,同时涵盖大量新型生物材料及其(潜在)创新医疗产品。三个维度交织可产生多个研究主题,即针对具有目标临床应用和医疗产品的不同生物材料所输出的监管科学研究。
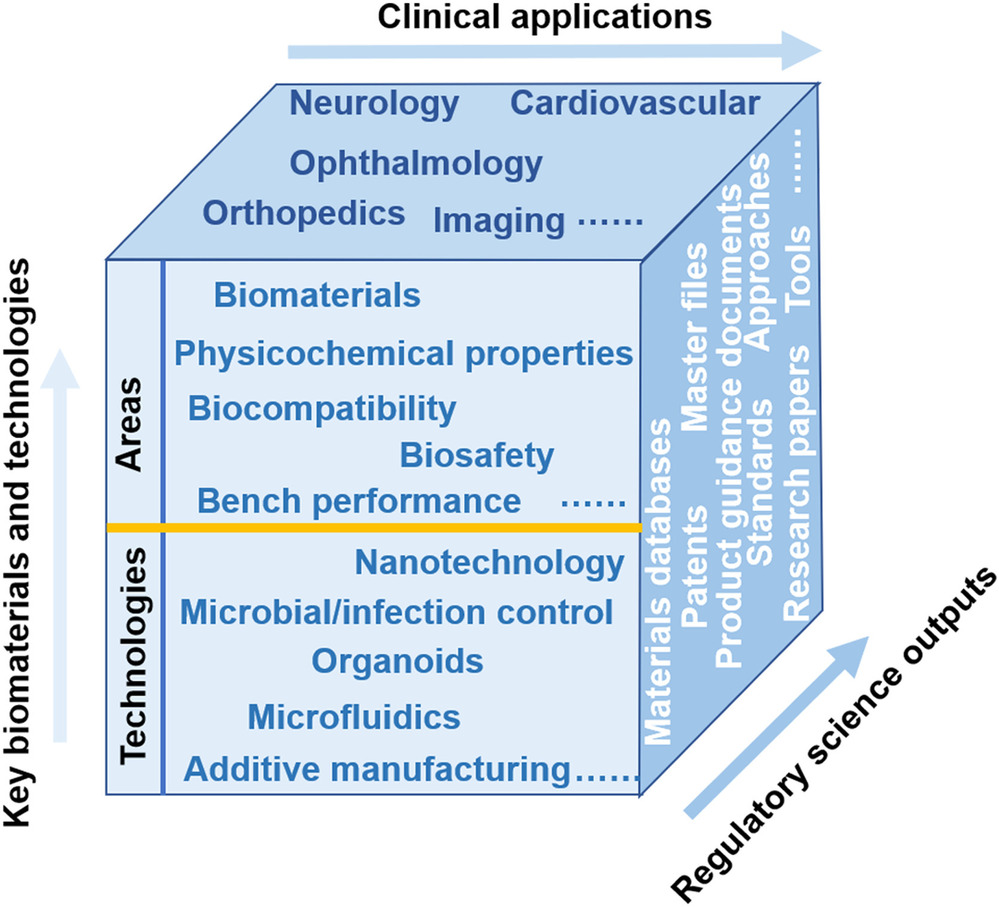
图4. 基于生物材料的监管科学体系。

总结与展望
作为国际首篇全面阐明生物材料与监管科学关系的文章,所提供的关键信息还包括:生物材料的最新定义涵盖了广泛的应用和研究领域。生物材料是医疗产品的一部分;监管机构批准的是终产品,而非生物材料。没有所谓的医用级和植入级材料的法规定义,但监管机构认可相关生物材料标准。监管科学通过评估终端医疗产品的安全有效来满足监管/行业需求, 实现其使命。FDA 和 NMPA 都在生物材料相关的监管科学项目上取得进展。生物材料的监管科学研究可以通过开发新的工具、标准和途径来推进,例如界定和分类系统、标准体系、主文档制度和基于生物材料的监管科学体系。
